一、遵循法律法规
1.《涉及人的生物医学研究伦理审查办法》中华人民共和国国家卫生和计划生育委员会令 第11号 2016年
2.《药物临床试验伦理审查工作指导原则》(2020年)
3.《中医药临床研究伦理审查管理规范2010》 国中医药科技发〔2010〕40号
4.《医学研究伦理审查体系管理规定(2018年第二次修订版)》中医一院[2018]71号
5.《赫尔辛基宣言》世界医学会(2013年)
6.《涉及人的健康相关研究国际伦理准则》世界卫生组织•国际医学科学组织理事会
7.《医疗器械临床试验质量管理规范》(2016年)
8.《药物临床试验•广东共识》(2020年)
9.《药物临床试验质量管理规范》(2020年)
二、研究生伦理审查申请说明
1. 我院所有涉及人的生物医学研究项目,研究者在进行研究之前均需呈送伦理审查,得到伦理委员会的批准后方可实施;
2. 涉及人的生物医学研究项目负责人须具有我院职业资格,副高以上职称,并应当具备法律法规规定的资质,经过GCP、受试者保护与利益冲突政策培训,且具有相应证明材料;在读研究生提交伦理审查申请,研究项目负责人为研究生导师,研究生为审查申请人和联系人;
3. 教研分会仅受理具有bwin必赢学籍的在读研究生(全日制国内研究生、全日制港澳台及外国留学生)为项目参与者和联系人的在本院开展医学研究项目的伦理审查;其他培养类型研究生,包括兼读制港澳台研究生、以同等学力申请博士、硕士学位人员、外单位联合培养人员、在本院临床轮训但学籍不在本院人员的申请属于收费项目,须向医院伦理委员会提交申请,联系人黎欣盈老师(36588667,每周一下午、周三下午);
4. 研究生开展的研究项目属于导师已开展的研究项目的子项目,导师的研究项目已获得医院伦理委员会审查批件,且研究生研究子项目有关研究工作不超出原伦理审查批准实施的范围,则该子项目不需重新申请伦理审查,使用导师的伦理审查批件即可;
5. 递交审查研究项目的研究内容和研究方案必须已通过研究生学位论文开题报告会,由研究生导师、导师组负责审查研究项目的学术价值、社会价值、可行性和创新性;
6. 提交伦理审查申请资料中有关研究方案、知情同意等内容,涉及引用他人研究结果和研究数据的,务必谨慎核查、如实引用,一经发现弄虚作假者,将按照学术不端有关管理规定严肃处理;
7. 伦理审查批件仅适用于在本单位开展的相关临床试验研究、观察性研究、数据收集和资料采集等;研究生在外单位开展合作研究,应取得该单位伦理机构许可证明;
8. 在学术刊物上发表涉及人的生物医学研究成果时,作者在投稿时应同时提供该课题的伦理委员会审查批件;
9. 研究生开展与学位论文研究工作密切相关的临床研究,取得的伦理审查批件应在学位论文中作为附件材料,提交参与包括校外双盲评审和各级学位论文抽查工作;
10. 研究生递交伦理审查申请的时间不得迟于该生申请学位的前6个月,如2019级研究生于2022年6月份申请学位,则递交伦理审查时间应为2021年12月31日之前,以此类推,逾期不予受理;
11. 审查流程历时一般不超过10个工作日,特殊情况除外,具体见学院网伦理专栏通知。
三、对申请项目需遵循伦理原则的几点说明
1. 免费和补偿原则:
根据国家2016年《涉及人的生物医学研究伦理审查办法》第十八条“(三)免费和补偿原则---对受试者参加研究不得收取任何费用,对于受试者在受试过程中支出的合理费用还应当给予适当补偿;”
随机试验性研究不得收取受试者任何费用,即申办方需承担包括研究过程中使用的药物(常规药、对照药)、治疗措施(针灸、手法治疗、仪器设备治疗等)、检验项目、治疗材料等的费用,对需多次复诊、需采集样本检测的受试者应当给予适当、合理补偿。
申请项目应根据项目经费支撑等实际情况做好研究类型设计。
2. 知情同意原则:
根据国家2016年《涉及人的生物医学研究伦理审查办法》第十八条“(一)知情同意原则—尊重和保障受试者是否参加研究的自主决定权,严格履行知情同意程序,防止使用欺骗、利诱、胁迫等手段使受试者同意参加研究,允许受试者在任何阶段无条件退出研究;”
各类型研究项目应遵循知情同意原则认真填写、严谨表述并提交《临床研究知情同意书》,材料中避免出现“疗效显著”、“免费提供”等诱导性语言文字表述;
对利用以往临床诊疗中获得的病历资料数据的研究、利用其他研究剩余的生物样本的研究(受试者在原研究签署的知情同意书已同意其生物样本二次利用)、不大于最小风险的电话访谈、调查问卷等研究,可提交《知情同意例外申请》,申请免除签署知情同意书,并提交电话访谈(若涉及电话随访)、调查问卷的简要口头知情同意的文字表述文档材料。
3.保护隐私原则:
根据国家2016年《涉及人的生物医学研究伦理审查办法》第十八条“(四)保护隐私原则—切实保护受试者的隐私,如实将受试者个人信息的储存、使用及保密措施情况告知受试者,未经授权不得将受试者个人信息向第三方透露;”
各类型研究均需严格遵循保护患者或研究参与者个人隐私原则,包括在《临床研究方案》“数据安全监查”和“临床研究伦理学”中、《临床研究知情同意书》中关于患者隐私权保护的严谨表述,以及提交《保护患者或研究参与者个人隐私承诺》等;
在未经受试者知情同意的情况下,研究不得采集患者姓名、身份证号码、联系电话、住院号等可识别患者身份的个人信息。
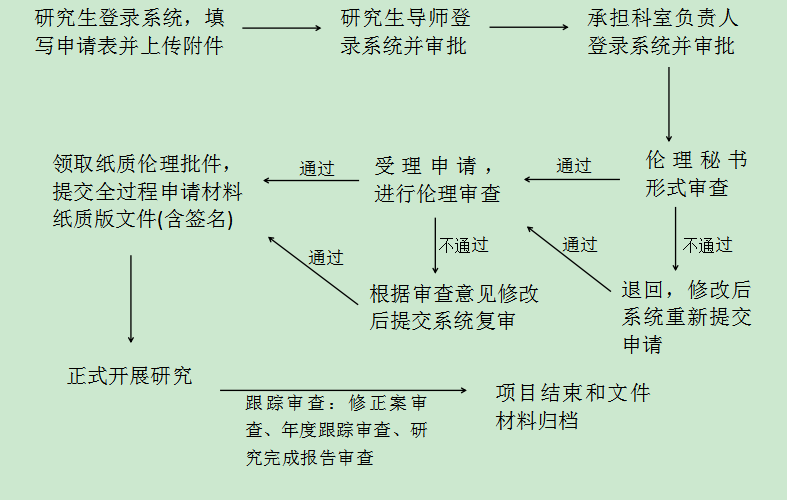
四、研究生伦理审查申请流程

2. 伊柯夫电子系统审查:
五、伦理审查申请管理
1. 审查受理部门:第一附属医院医学伦理委员会教研分会;
2. 负责工作秘书:研究生管理办公室 黄纯美
3. 工作时间和联系方式:每周一下午、周三下午2:30-5:30,地点:大学综合教学楼919,电话:36585411,工作邮箱:530000739@qq.com;
4. 伦理咨询网站:bwin必赢—伦理专栏。
广州中医药大学第一附属医院医学伦理委员会教研分会
2022年1月
